2024年5月13日,我校生命科學學院教師吳志平博士團隊(第一作者及通訊作者單位為中國計量大學)撰寫的觀點評述性文章“The quest for drug delivery holy grail”在線刊登于Science雜志網站的eLetters平臺。
藥物研發是一個復雜而耗時的過程,先導化合物發現和優化是其中的一個關鍵階段。隨著人工智能的快速發展,制藥工業與學術界對于實現這一過程的智能化越來越感興趣。然而,在該領域中,要獲得高質量的訓練數據和在未知的化學空間中搜索候選者仍然存在重大挑戰。最近,美國麻省理工學院Brent A. Koscher 研究團隊在這方面的研究取得了重大突破,2023年12月22日在Science雜志上發表題為 “Autonomous, multiproperty-driven molecular discovery: From predictions to measurements and back”的文章。
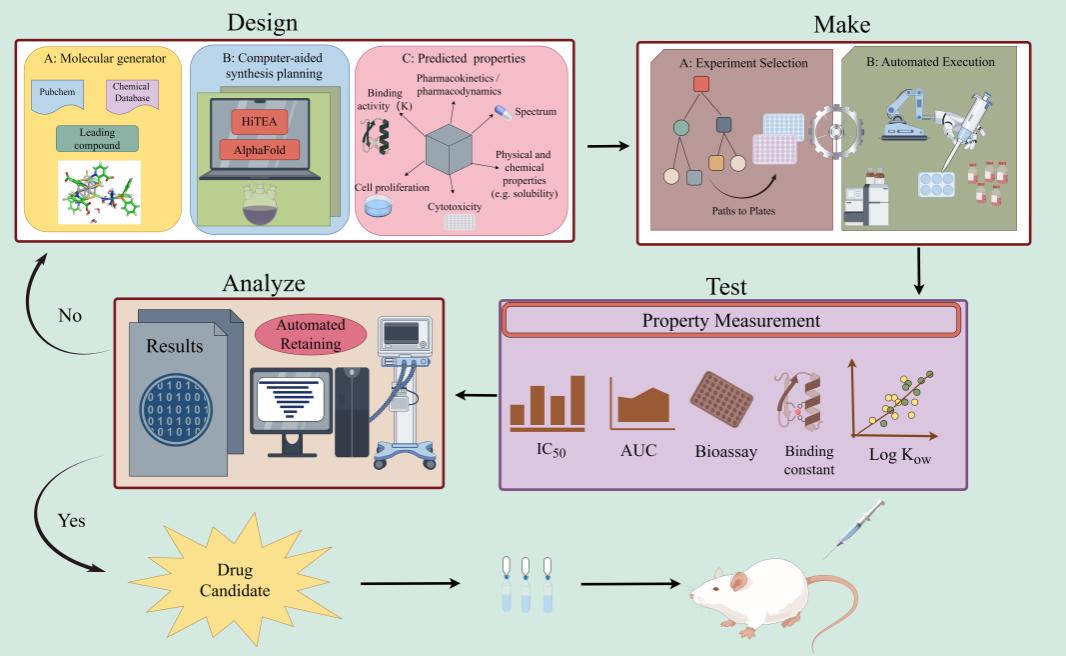
Brent A.Koscher 研究團隊以化學合成大數據為基礎,結合人工智能和現有自動化技術創造性地開發了一個高度智能化平臺,并以設計具有指定特異性功能的染料分子結構為例,成功地驗證了該平臺的功能。該平臺可以通過現有結構數據庫的演繹分析來探索未知化學結構-性質空間,大大地拓寬了化學分子的設計空間;并通過實時合成目標分子,實時測定其性質,反饋優化設計,得到更接近于指定功能的化學分子,經多次迭代得到理想的候選物(先導物)。
此研究一經發表,便引起了吳志平博士研究團隊的高度重視,經過詳細研究后認為可以將Koscher平臺的功能擴展到藥物先導物的發現和優化(hit-to-lead)過程中,從而有可能引起先導藥物智能化發現與優化革命性的突破。本文指出在新藥研發過程中,潛在候選藥物的理化性質和生物活性是藥物發現的關鍵,這為其可能的靶點和機制以及是否具有進一步的開發價值提供了信息。通常,具有理想生物活性的候選藥物是通過一系列結構優化實現的,中間化合物的數據是每一步的關鍵反饋。Koscher平臺正具有實現此過程的潛在前景。不同于以往模型預測和有限的化學空間檢索,該平臺利用模塊化方法結合機器學習(ML),允許整入新型技術設備模塊來測定藥物活性并可適應不同類型的新藥研發。本文指出雖然藥物活性的自動化測定的挑戰性遠高于染料分子性質的測定,但高效準確評估大量候選藥物的高通量技術、模擬活生物體微環境并允許精確控制藥物-生物分子相互作用的微流體芯片,以及為識別藥物及其代謝物結構提供強大工具的尖端質譜技術和軟件的快速進展為自動化優化篩選先導物提供了可靠的技術基礎。
用于決策的人工智能是一個數據驅動的分析過程,在很大程度上取決于訓練數據集的質量和數量。然而,包括化學和藥物化學集在內的大多數流行數據庫都是基于文獻和專利積累的數據,缺乏低效、失敗和非典型反應的相關數據。因為缺乏藥物發現的負面數據包括對患者有不良反應或沒有預期療效的數據,藥物開發人員發現很難準確評估與其產品相關的風險。功能強大的高通量數據(HTD)分析軟件HiTEA與眾不同之處在于其在HTD中提取負相關性的能力,而傳統文獻數據庫往往缺乏這種能力。這在藥物化學領域尤其有益,因為缺乏負面數據將大大限制藥物開發人員深入了解化學空間。HiTEA的不斷升級演化,可以從海量的數據中挖掘出合成特定類型藥物最有效的試劑和合成條件,從而有可能大幅度提高成功率并降低成本。同時,強大的3D蛋白質形狀預測工具AlphaFold的出現也為平臺拓展到先導化合物的發現和優化提供了基礎。因此,本文特別強調將HiTEA和AlphaFold等集成到Koscher平臺中可以大幅度提高平臺的性能。隨著這些工具的集成,藥物發現的“圣杯”觸手可及。
注:《Science》eLetters欄目為電子版,主要刊登由《Science》編輯精選出的針對近期內發表于《Science》雜志論文所做的評論性文章,以促進全球科學交流。
文章鏈接:https://www.science.org/doi/10.1126/science.adi1407